Home › フォーラム › 第3回 希少がん患者サミット › 希少がんの治療薬に関する、困りごと・経験・意見などを教えてください
タグ: druglag
- このトピックは空です。
-
投稿者投稿
-
-
あるがまま
この様な場があってとても助かります。10月の上旬の健康診断で検査技師の方に「今まで膵臓で何か言われたことがありますか?」と聞かれてこれは何かあるな‼️と感じて心配しておりましたが1ヶ月半たった時点で「病院受診してください。」といわれました。翌日病院受して検査をしましたが再度検査の予約を入れ、検査の結果が神経内分泌腫瘍の疑いで大学病院にこの後の検査に行くように言われています。健康診断についても疑問があり、病院受診をすすめる人の結果説明が問題ないと言われた人の結果よりも遅くしかも検査後1ヶ月半もたってからの説明にちょっと憤りを感じてしまいました。あまり問題ない内容であれば仕方ないなとも考えられますが問題がでてきてみるともう少し早く結果説明ができないものか?とどうしても考えてしまいます。YouTubeから神経内分泌腫瘍の情報を集めることができ、ある程度の心の準備をしています。正月開けての受診になりますがこの場に出会えてよかったと感じています。
-
斜めがけ座椅子
元々私は子宮頸がんで手術を行っており、2024年7月に再発と医師から診断を受け再度摘出手術を行った所デスモイド腫瘍を患っていると発覚しました。
お世話になっている病院にデスモイド腫瘍を専門に対応している先生がいらっしゃったのでお話を聞いたところ、特に焦る病状ではないから様子を見ていきましょう。と言われて軽い感じで終わりました。
特に治療薬も無く経過観察のみで対応と言われてしまい、今後も子宮頸がんの再発もしくはデスモイド腫瘍の再発きちんと見比べる事は出来るの?また誤診しない?とやや不安を抱えています。-
Sumito
一度そう言う事があると、不安になりますよね。
ただ、難しい問題だと思います。
おそらく99%は再発という診断で間違いないのだと思いますが、極ごく稀に違う腫瘍や希少な疾患でした!、という事があるので、ではどうすればよいだろうと考えた時に、診断の精度を求めるというよりは、最初の所見で他の腫瘍、疾患を疑う知識や経験値があるかどうか、という事が課題として見えてきます。
ですが、それを全ての医療者に求めるのは現状では酷でもあるでしょうし、そこに私達の根本的なジレンマがあります。
希少疾患の組織が行っている「ゼブラ運動:蹄の跡をみたら馬を連想しろという、迅速な診断に努めるよう教える格言に対し、馬の中にもシマウマがいる事を忘れないで‼という希少疾患の啓蒙運動」のような活動を地道に行っていく事と、今回の斜めがけ座椅子さんのような経験談を広く伝えて行き、医療者の方々に、常に意識しながら診断に当たってもらう、という状況に持っていく事が大事ですね。。
-
-
融合遺伝子パネルを届けたい病理医
私は、病理医です。骨軟部腫瘍をはじめ、一つ一つは10万人に6人未満で、200種類以上の希少がんの病理診断は、難しいです。一生に一回遭遇するかどうかです。特に、特徴のないがん細胞が、ひたすら増えて塊をつくる肉腫は、顕微鏡でみても、区別ができません。病理診断に使える遺伝子パネルはありません。正しい診断がつかず、亡くなる若者にしばしば悔しい想いをしてきました。
3年半前に、肉腫に多い遺伝子異常である融合遺伝子を見つけることが得意な、RNA panel に出会い、目からウロコでした。診断の段階で、このパネルを使うことが出来れば、これまで診断がつかなかった肉腫やNUT がんのようながんの正確な診断が、今より早くつくようになると期待されます。
正しい治療は、正しい診断が不可欠です。
多くの人に知って頂きたいと、投稿しました。-
Sumito
大変貴重な情報をありがとうございます。
希少がん患者の悩みも全く同じです。メジャーながんであれば正しい診断に行きつくのは容易でしょう。ですが、同じように生き、同じように生活してきて、たまたま掛かったがんが希少なものだったというだけで、診断に何年も要するようなハンデを負ってしまう。普通に考えて納得できるものではありません。ですが、現状は同じ部位のがんの治療に準じて、ある程度治療を進めてみないと、パネル検査という話も出てきません。いざ、がん遺伝子パネル検査となれば、有用なパネルを利用して正確な診断へ繋げてほしいですが、それ以前の問題も大きいと思います。
様々なパネルがありますが、がん種、疾患に応じてパネルを選べるようになると良いですね。
-
Sumito
大変貴重な情報をありがとうございます。
希少がん患者の悩みも全く同じです。メジャーながんであれば正しい診断に行きつくのは容易でしょう。ですが、同じように生き、同じように生活してきて、たまたま掛かったがんが希少なものだったというだけで、診断に何年も要するようなハンデを負ってしまう。普通に考えて納得できるものではありません。ですが、現状は同じ部位のがんの治療に準じて、ある程度治療を進めてみないと、パネル検査という話も出てきません。いざ、がん遺伝子パネル検査となれば、有用なパネルを利用して正確な診断へ繋げてほしいですが、それ以前の問題も大きいと思います。
様々なパネルがありますが、がん種、疾患に応じてパネルを選べるようになると良いですね。
-
-
ぐっさん
答えが見つからないデスモイド腫瘍。
これといった治療がなく、日々増していく痛みで効く薬もなくなった。抗がん剤治療をしよつにも、癌保険は適用外。
今生きているだけでも辛いのに、手立てがなく、この先の不安しかありません。-
Sumito
ぐっさん さん
稀少な疾患という事で、助成などの制度が追い付いていないのが現状ですよね。
私達、RCJでは希少がんの皆さんが小さいながらもグループを作って、今後の事を話し合っていけるようなネットコミュニティーを
運営しています。
デスモイド腫瘍の方もすでにおられるようですので、よろしければご参加されませんか?
-
-
ひなこ
2023.2月、精神疾患を有する長男(当時40歳)がA病院で鼻腔がんの診断を受けました。当初は『嗅神経芽細胞腫』の見立てでOPE前提と更なる精査目的(この時点でA病院は神経内分泌がん疑いとしていました)でB大学病院を受診する運びとなりました。B大学病院は日本の最高峰の医療機関であると認識しています。
B大学病院の受診予定日まで3週間の待機期間があり、その間、長男のがんは急速に増大増悪し鼻腔閉塞、鼻耳出血、眼球突出、腫瘍圧迫による口腔内の痺れ、嚥下困難、果ては気道閉塞の可能性もあり生命の危機を感じるためB大学病院への受診を早めてもらえるようA病院に同行し訴えましたが、『大学はそんな対応しません。きちんと予約日を守ってください』『今すぐに息が止まる訳ではないので危なくなったら救急車でも呼んで対応してもらってください。』と喘ぐような呼吸をしている長男共々、帰宅させられました。
嚥下困難のため長男は向精神薬の服用もままならず日に日に精神状態も悪化しB大学病院受診時にはかなりの荒廃した精神状態となりました。
B大学病院で鼻腔がん・神経内分泌がんNECであることが確定しましたが、画像所見から癌が急速に広がり頭頸部内の広範囲に及びもはやOPE適用ではないと告げられました。
更に荒廃した不安定な精神状態の患者には抗がん剤治療も行うことは出来ないと告げられました。
精神科のコンサルもありましたが、精神科からも安定して抗がん剤治療を受けるのは困難。緩和ケアへの移行を勧めるという判定でした。
どうしても積極的治療を望むのであれば唯一『放射線治療』ならば耐えうるかもしれないと言われ地元のC大学病院を紹介されました。
病名発覚からC大学病院に至るまでの約2ヶ月を長男は全くの無治療で過ごしました。呼吸はかろうじてヒューヒューと喘鳴様。飲食はヴィダーinゼリーやカロリーメイト、アイスなどで凌いでいました。
C大学病院では、放射線治療を目的としての紹介受診でしたが、前例はほぼない症例ではあるが文献等によると性質が似ていると言われる小細胞肺がんの標準治療に則して抗がん剤治療を試みてみましょうという流れになりました。C大学病院の精神科も共観くださり安定した精神状態でEP療法4クールを完遂することが出来ました。
幸い1クール目の抗がん剤治療が好奏し長男の崩れ落ちた顔は癌が縮小し元の顔に戻りました。
抗がん剤の副作用はあるものの少量ずつでも食べたいものを口から食べ飲み込むと言うことが出来るようになりました。向精神薬の投与も適切になされ極めて安定した精神状態で長男は過ごすことができました。2023.4月から6月の3ヶ月間は、わたしども家族にとってかけがえのない『恵みの時間』を享受出来たと思っています。
その後、放射線治療を経て退院、通院、自宅療養と移行しましたが、残念ながら肝転移したNECが急速に増大増悪し8月、長男は眠るように旅立ってしまいました。
希少がんゆえにほとんどの情報にアクセス出来なかったこと。精神疾患であるがゆえに初動対策に応じてもらえなかったこと。孤立した家族が寄る辺となる『場』も見つかるゆとりがなかったことを今更ながらとても残念で悔やまれてなりません。
後付けですが、母親であるわたしは長年、高度医療の現場で勤務している看護師です。
同僚の医師や看護師、検査技師に尋ねても『神経内分泌がんNEC』については、よくわからないと言われました。
息子の顛末は聞きたくないと思われる現治療者さん、ご家族さんもおられると思いますが、わたしどものような一例も踏まえて今後の加療に役立てていただけることを願っております。-
Sumito
ひなこ様
大変貴重なお話をありがとうございます。RCJ理事のSumitoと申します。
私も遺族ですので、1年も経たない中でお話しいただくのは、お辛いところもあると思いますし、本当に感謝いたします。全ての病院が希少がん、希少疾患に対応できる訳ではなく、しかも病院や、その時に在籍している医師によっても、得手不得手とする疾患が変化していくでしょう。
その辺りをきちんと整理して、今その地域でその希少がんであればこの病院へ、という情報が常に提供できる体制づくりが理想ではあります。がん診療連携拠点病院等の指定要件には、地域の病院間で情報交換を行い、希少がんの診療体制を整備する事が義務とされています。ただ、希少がんの種類は200
種類とも言われていて、全ての希少がんの情報を集めるなどできるはずもありませんし、希少がん患者のために動こうなどと考える医師も少数です。ですが、ようやく各地に「希少がんセンター」ができ始め、地域のハブ・ステーションとなって、患者さんへの情報提供を充実させていこうと動き始めているのも
事実で、私達RCJも患者会のネットワークとして、その体制の中で何ができるのか、理想に向けて何が必要なのかを考えています。
その一つが、皆さんの体験・経験、そこから得られる知識などを、いかに地域の情報として積み上げ、活用できるようにするかという事があります。
例えば今回、ひなこ様から頂いた病院の情報、治療の選択肢、得られた結果、一つ一つが大変貴重な情報です。きちんとした形でご提供いただいて、必要なマスキング
などを経て公開する事で、体験談として、同じNECや頭頚部がん、咽頭がんの方々にも参考にしていただけるかと思います。発信された情報をきちんとまとめ、必要とする患者さんやご家族へつなげていく「ナレッジ・マネジメント」が今後とても重要になってきます。
現在私どもRCJでは「raccoon」というオンライン・コミュニティを運営していますが、今イチ稼働率が低く、活用しきれていないのが現状です。ただ、今後ますます工夫を
重ね、皆様の経験の「ナレッジ ベース」として、必要とする方へ情報が届くよう、希少がん診療のデータベースに育てていければと考えています。今後もぜひ私どもの
活動にご指導、アドバイス等いただければ幸いです。最後になりましたが、息子様のご逝去からこの8月で1年なのですね。この時期は良い時間であったとの事、思い出される事も多いと思います。
あらためて故人のご冥福をお祈りいたします。
-
-
大
私は脳腫瘍であり脳幹部に腫瘍が発生した。
大学病院に転院して摘出手術、シャント手術を行う。
父は、私の病気で宗教団体に入会してしまった。
父は、医師の言葉に喜んでいたが治療して17年後に再発してしまった。
患部に放射線を当てても他の部位ががんになるとして
点滴の抗がん剤を10ヶ月程やりました
そのご鬱病になってしまい大学と大学院で留年しました。
留年しても博士前期課程を修了は、しました。
今希少がんでやれること患者の心のケアが重要になってくると思います。
小児がんは、抗がん剤を大人より多くして治療する場合もあります。
子供にとっては、辛い治療になります。
QOLを考えると患者とその御家族の心のケアが1番重要だとおもいます。
あと小児がんからAYA世代において病院内に高校生が学べる院内学級が必要だと訴えます。
今は小児がんをみている小児がん拠点病院は、昔からすれば増えたためチャイルドスペシャリストも増えてきてます。
また同一のがん患者と交流することができず
モヤモヤしたのを思っていました。
未だに同じような治療した患者様に会えていません。-
Sumito@RCJ
大さん
RCJで実施したアンメットニーズ調査2022でも、おっしゃるように「心のケア」は特に小児がんの皆さんに多く求められています。
https://rarecancersjapan.org/jp/wp-content/uploads/2023/02/rcj_umn230120fin.pdf
4ページ目の「がんに関連した症状へのケア」の項では、がん全体の回答をがん種ごとに分ける事で、それぞれの特徴が表われています。
となり5ページの「初めての治療で必要な情報」と合わせて見ても、小児がん患者の皆さんには、治療開始の初期から「心のケア」へのニーズが高い事が分かります。
私も所属する団体でこのアンケート結果を要望活動へつなげていきたいと考えていますが、RCJには脳腫瘍に関連した患者会が複数参加されていますので、ぜひ大さんもモヤモヤの解消ができる場所や仲間を探したり、実際の活動に関するナレッジを得ていただければと思います。
-
-
なつ
癌腫による縦割り医療の弊害。
癌腫縦割り型医療が
希少がんをうみつづけている症例が集まらないから希少部位の癌について
治験ができない。と言う負のサイクルが回り続けてしまう。
治療法が確立していない堂々と言うならば
希少がんの患者には、類似臓器の標準治療や
治験によるエビデンスがない(希少部位での確認がとれていないだけ)治療でも
治験的にどれでも選んでうけられるような
制度を作って、目の前にある希少な一件一件が治験のつもりで
様々な可能性をトライさせてくれるような
制度があってもよいのではないかと
希少がんとされる病気になって考えました。
そんな人体実験のようなことは医療で行えない!
なんて、もっともらしい言葉が聞こえてきそうなものですが、
治療法が確立してない、と堂々と病院が言うこと自体が
治療法がない状況でどのように死んでいくのか、という
壮大な人体実験をしているようなものであり、患者の生きたい!と言う
願いに蓋をする行為。とくに、免疫治療においては明らかに癌腫を超えた
考え方の治療法なのだから、いの一番に
希少がん患者にたいして門戸をひらいて
トライさせてよい治療法だと思う。エビデンスがないから出来ない、
は、
希少がん、と、区分され取り残された
患者に対してはやめにして
むしろ全ての治療を試すことが出来る
ラッキーな患者達、ってなることを祈ります。
そうなるように同志を募って活動したい-
Couji2
なつさん
おっしゃる通り、希少がん患者だからこそ、可能性のある治療を制度の枠組みを超えて優先的に試させて欲しいと思います。ですができれば科学的な根拠によって、可能性の高いところから試していく事ができればもっと良いですよね。
ある1種類の希少がんに注目を集めることは容易な事ではないと思いますが、同じ考えの仲間たちで活動が始められるなら、今はそうした道も開かれる可能性はあると思っています。例えば希少がんであれば「がん遺伝子パネル検査」は保険診療で受けられます。現在は遺伝子情報が得られても治療薬がないため、検査によって治療にたどり着ける患者さんは10%未満とも言われていますが、いずれ全ゲノム解析も始まるでしょうし、治療法のないとされる希少がんであっても、遺伝子の変異や異常に発現している蛋白質などが特定できるのであれば、それを一つのターゲットとして現在研究が進んでいる、マルチオミックス解析、蛋白質解析(プロテオミクス)等のデータからの新薬開発、あるいは既存の薬剤から効果が見込めるものが見つかる可能性(リポジショニング)もあります。
先ずはご自身のがんのプロファイルを正しく知る事、同じ、あるいは似たプロファイルの仲間で集まり情報を共有する事、その道の専門家(専門医・研究者)を探し、繋がる事、を一つずつ進めていく事が大事なのかなと思います。
-
-
Sumito
小児がん・難病治療薬の「ドラッグラグ」解消へ、新制度検討…米の法制度を参考に
~小児のがんや難病の治療薬の国内承認が海外より遅れる「ドラッグラグ」の解消に向け、厚生労働省は新たな制度の導入を検討する。小児用の薬を大人用と同時に開発することを求める米国の法制度などを参考に、厚労省研究班が3月末にもまとめる提言を踏まえて、開発促進につなげる。~
➡ がんの分子標的薬を開発する際は小児用も同時に進めることを義務付ける法律
なのですが、当然ですが開発コストもかさむ事となりますので、製薬業界の間では逆に日本国内での開発を敬遠する一因になりかねないとの懸念が広がっているようです。新薬創出等加算や市場拡大再算定の運用についてきちんと議論したうえで、企業に対するインセンティブなど、開発に見合う利益が得られる制度改革でなければ、結局、制度自体が破綻することになります。
後先の事を考え、調整していくのが国の仕事だと思うのですが・・https://news.yahoo.co.jp/articles/eed389eb67e6f74753335196ffacdcf7341e3c7f
行方を見守りたいと思います。
-
Sumito
-
-
sunu
今朝新聞を見ていたら、このような記事がありました。
医療個人データ提供、希少症例などで大幅拡充…創薬・治療法研究を推進 : 読売新聞オンライン
https://www.yomiuri.co.jp/science/20221015-OYT1T50264/ネットでは登録が必要で、全文を読むことは出来ませんでしたが、これはドラッグラグ解消に向けた第一歩になり得るのでしょうか。
-
sunu
少し前の記事ですが、このような記事がありました。
「救える命も救えない」ドラッグ・ラグ深刻な日本、小児がんの裏事情
https://www.asahi.com/articles/ASQ9P4RKSQ9JUTFL017.html-
Sumito@RCJ
sunuさん
情報提供をありがとうございます。
記事にも書かれている通り、希少がんでは必要な薬剤にアクセスできない問題が根詰まりを起こしており、
その原因の一つが小児がんに対する薬剤の開発の遅れと、国の支援体制の無さだと思います。
必要な法整備は急務です。ぜひ声を大にして訴えていきたいですね。添付ファイル:
-
-
Yoshino
希少がん患者サミットを開催していただき、ありがとうございました。
コロナ禍の中で、ご準備を進められるのも大変だったのではないかと思います。本当にお疲れ様でした。
事前に少し勉強していましたので、とても有意義な内容でした。ボリューム的にもちょうど良かったと思います。ただ、一緒に見ていた主人には少し難しかったようです。また、ある程度解決へ向けての答えが欲しかった人からすると、つまらなく感じてしまう方もいらっしゃったかもしれません。
ですが、日本が直面している問題がとても良く見えて来ましたし、既存の制度やインセンティブでは解決できる問題ではない事も良く理解できました。
今後も活動を継続されるとの事ですので、ぜひステークホルダーの皆様で話し合っていただき、次回の開催の時には、少しでも解決への方向性を示していただければと思います。これからも期待しています。-
Sumito@RCJ
ご参加いただきありがとうございました。
産・患・学という事で一部のステークホルダーのみで開催いたしましたが、次回はもっと広く様々な分野、お立場からお集まりいただきたいと考えています。
今後ともよろしくお願いいたします。
-
-
Patch
骨髄増殖性腫瘍患者・家族会(MPN-JAPAN)です。
ドラッグラグを多く経験しています。私自身が服用している薬も、米国より、17年くらい遅れて承認されました。現在は、海外で開発が進んでいる薬の製薬企業に直接要望し、日本で導入してくれるように、患者・家族会から、日本に拠点のある製薬会社数社に協力をお願いしても断られました。
海外のベンチャー企業はアジア地域で治験を行っていても、日本を含めていません。韓国やシンガポールでは治験が行われ、先に承認されています。希少疾患であり、事業性も低く、日本の企業でもMPNに関心・知識のある企業が少なく、日本のドラッグラグは顕著です。
-
Sumito@RCJ
ご経験談の紹介をありがとうございます。
ホームページも見させていただきましたが、患者会と専門医と呼ばれる先生方が連携しながら、患者や家族の皆さんへ情報提供されている活動は素晴らしいと思いました。
やはり今の状況では、海外企業の誘致は難しいのですね。私たちGISTの新薬に関しても10社近い企業さんに依頼をして、CROさんに実際に海外の振興バイオ企業と交渉もしていただいたのですが、そもそも先方が日本での上市を望んでおらず、交渉できずに終わってしまったとのことです。
おそらく他の希少がんでも同じことが起こっていると思うのですが、もし他の患者会の皆さんのご協力を得られるならば、PMDAやNCCの未承認薬リストhttps://www.ncc.go.jp/jp/senshiniryo/iyakuhin/list.pdf
から、希少がんだけを抜き出した「希少がん未承認薬データベース」が、もし作れたら、横の連携も意識できますし、協力しながら厚労省や企業への要望活動ができるのではないかと思います。あとは、例えば合同で希少がんの患者会とCRO、製薬企業が合同でワークショップを開催して、海外の振興バイオとの連携について考えたり、実践している企業さんから学んだり、そんな事ができないかなと考えています。
-
-
とめ蔵
肉腫患者です。同じ肉腫の種類でも、初回術後補助的に行う抗がん剤が違ったりします。分子標的薬も、地域・病院・医師によって始め方など使用方法が違ったりします。
こういうことは、A剤が効かなかったらB剤、B剤が効かなかったらC剤、など、次の薬を選択するときに「A剤を使っていたらC剤は使えない」などといった支障は出ないのでしょうか。また患者申出療養制度などを使う際に、問題はないのでしょうか。-
豆助
A剤を使っていたらC剤は使えないとかって、あるかもしれませんね。標準的治療から外れた薬剤を使うと、新薬の治験に入れないとか、そういうことがあると聞いたことがあります。
-
-
Sumito@RCJ
今回は治験が終了して承認申請が提出された後に発生するラグについてです。日本では新薬の承認審査を「医薬品医療機器総合機構:PMDA」という厚生労働省所管の独立行政法人が行っています。
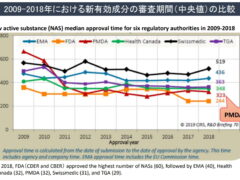
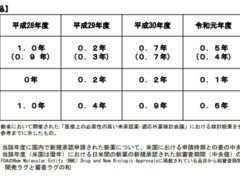
新薬の審査期間については、CIRS(Centre for Innovation in Regulatory Science)という機関が毎年調査を行っているのですが、2019年までのデータを見る限り、問題となるほどのラグはすでにないように思えます。グラフでは2009年から2012年にかけて一気に審査期間を縮めていますが、実はこの間、大幅な増員と業務改善が行われていました。私は2007年3月に新薬の早期承認を求める要望書を提出するため、厚労省を訪問していますが、その際「PMDAはこれから大きく変わる、期待してほしい」と当時の審査管理課長さんが話されていたのを思い出します。開発ラグ、審査ラグ、それぞれの視点から改善が進み、PMDAの令和2年までの試算ではドラッグラグは0.7年との結果が公開されています。
他にも、例えば臨床研究中核病院を設置して、そこを核として国内の治験や臨床研究のためのネットワークを構築することで、被験者の集積が図られ、国際共同治験などの臨床研究がスムーズに進むようになったり、治験相談及び事前面談を通してPMDAと製薬企業の連携が密になったことにより、治験そのものや審査にかかる時間も短縮されたりと、いくつもの成果が合わさって、日本のドラッグラグは解消される寸前まで来ていたと思います。
ではどうして今治療薬が日本に入ってこなくなってしまったのでしょう。
次回は新たな問題「ドラッグロス」について書いてみます。
添付ファイル:
-
Sumito@RCJ
9月17日(土)銀座5丁目にある「銀座ユニーク」さんで、第3回希少がん患者サミットの収録が行われ、無事に終了いたしました。当日、ご視聴くださった皆様本当にありがとうございました。当日チャットやメールでいただいたご意見ですが、こちらに転載できないか相談中です。もうしばらくお待ちください。
当日の先生方のご講演は後日オンデマンドにて公開予定です。
希少がんにおけるドラッグ ラグの問題には非常に複雑な背景があり、解決までの道のりは簡単には開きません。ですので今回のサミットは言わば「kick off」という感じで、さらに意見交換の幅を広げながら立場を超えて皆さんと進んでいきたいと思います。
今回、こちらではGISTの治療薬を例に、ドラッグ ラグの現状と、新たに生まれたドラッグ ロスについてお話します。
GIST(消化管間質腫瘍)はもともと放射線治療や抗がん剤がほとんど効かない、超難治性肉腫の代表のような腫瘍でした。ところが1990年代後半、当時阪大におられた西田俊朗先生、廣田誠一先生らの研究グループが、GISTが「カハールの介在細胞(Interstitial cell of Cajal; ICC)」 由来の腫瘍であり、GIST腫瘍の発生・進展にc-kit 遺伝子が関与していることを発見したことから、イマチニブという薬剤で腫瘍細胞の増殖が抑えられることが分かり、一気に治療環境が改善されました。
ただ、このイマチニブという分子標的薬は、GISTを完治させることは極々稀であり、約半数の患者さんは2年半~3年で効果が弱くなっていきます。続くスニチニブ、レゴラフェニブも同じで、しかも効果の持続期間は少しずつ短くなっていく傾向があるため、GIST患者さん達はイマチニブが登場した後も、外科的な治療を挟んだりしながら、3つの薬剤をうまくつないで治療を続けてきていました。
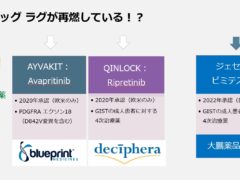
2013年承認のレゴラフェニブ以降、新薬が途絶えていたGIST治療薬ですが、2020年に一気に2剤がアメリカで承認、その後ヨーロッパでも承認されました。
ですが、この2剤、いまだに日本では使えません。
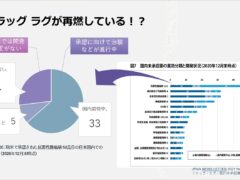
今年に入って日本でのみ開発が続けられた「ジェセリ錠:ピミテスピブ」が承認され、なんとか選択肢を増やすことができましたが、海外では使える有効な薬剤が、日本では未承認のため使えないという「ドラッグ ラグ」が再燃している事を身をもって感じています。ではこういった事態は、GIST治療薬だけのことなのでしょうか?
上記の2剤が欧米で承認された2020年、他の抗悪性腫瘍剤が未承認となっている割合を調べてみました。すると2020年末の時点で52品目の未承認薬があることが分かりましたが、そのうちの33品目はすでに承認に向けて治験などが進行中で、ドラッグラグであることには変わりありませんが、承認が見えている状態です。問題なのは「開発情報なし」とされている14品目です。こちらは製薬企業が日本で開発を行わずスルーされてしまった薬剤群で、先ほどのGIST治療薬2剤もこちらに入っていますが承認時期が全く見えない状態であり、こういった薬剤の問題を最近では「ドラッグ ロス」と呼ぶようになっています。
また、上の表からもわかる通り、抗悪性腫瘍剤は他の薬剤と比べても未承認となる割合が大きいように見受けられます。
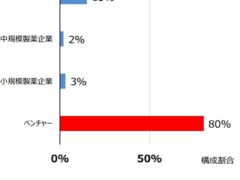
ドラッグ ラグを解消するため、厚労省は「医療上の必要性の高い未承認薬・適応外薬検討会議」を設置し、製薬企業に対しても開発を促し、承認へと繋げてきました。しかし今や世界の医薬品開発はほぼ創薬系のバイオベンチャー(EBP)と呼ばれる小規模の企業が担うようになっており、日本に代理店や支社がないために開発を促したり、日本へ誘致することが非常に難しくなっています。
しかも、以前の創薬系ベンチャーは、開発の成果を大企業へ売ることを最終目的としていましたが、最近のベンチャーは製造・販売までを行うようになり、その利益でさらに次の開発を進めるというのが一般的になってきていることから、最初の国際共同治験に入れないと、以降の誘致はさらに厳しいものとなってしまいます。下の表からもわかる通り、日本は3番目に上市される医薬品の割合が65%を超えており、このままでは未上市(この時点で17.7%)となる割合は今後も増え続けることになると思います。 -
Yoshino
ドラッグ・ラグについてはなんとなく理解できました。
最近は病院が指定を受けて、様々な役割を担っていますね。臨床試験中核病院では治験相談も受けてもらえるのでしょうか?-
Sumito@RCJ
Yoshinoさん
臨床試験中核病院も患者さんへの対応は様々ですので、病院HPなどで相談窓口のご案内を確認してみてください。
希少がんの場合には、全国に数か所ある希少がんセンターのホットラインで聞いていただくのも良いと思います。
全国の希少がんセンター ホットラインの一覧はこちらです。 これからまだまだ増えていくと思います。
https://www.ncc.go.jp/jp/rcc/hotline/index.html
-
-
工藤聡
仙骨脊索腫多発転移に侵されてます
薬が無く
困ってます-
Sumito@RCJ
工藤さん
希少がん掲示板へようこそ。
治療の事、お薬の事、一緒に考えていきたいと思います。
放射線・重粒子なども治療の選択肢に入ってくると思いますが、お薬が確かにないですね。
例えば放射線と相乗効果を生むお薬があればなといつも思います。
-
-
どうすりゃいい野
#216 yoshino さん
コメントありがとうございます。
Yoshinoさんがおっしゃって頂いた
パネル検査の件、
私の妻はパネル検査の結果
遺伝子変異数が多いTmb-high
にあたり、幸いにしてキイトルーダが適用できることになり
FOLFOXの次の治療手段が見つかって
ちょうど、そろそろ切り替えていく
ところです。これが合うか合わぬかわからないので
いずれにしても、引きつづき
次なる治療手段をさがしつづけなくては
ならないことにかわりありませんが。。。このように、
希少がん=治療法が未確立≒国立がん研レベルの病院も、がん中核病院もいずれの医師も、標準治療しか相手にしてくれない為、標準化手前の治療などは積極的には
紹介してくれず
医師も知識がないことが多く自分で調べてたどりつくしかないのが
今の現状。
そうしたところを、積極的にコーディネートしてくれるような
立ち位置のサポート団体があると
多くの患者さんや患者家族さんが
助かるのではないかと日々思います。個人個人で状況が異なるのは当たり前だし
希少な病でもそうでなくても、最後は
自己責任であることは変わらないのだから
もっと、病院や患者会や研究機関が
途方に暮れる患者たちを、
導いてあげるサポート体制があっても
いいのではないか?!と、、。なんだか、日々のグチをもらしたようで
すみません-
Yoshino
私は残念ながら遺族になってしまいましたが、今思い返しても、情報にたどり着くためにもの凄い労力と時間も費やしていたと思います。おっしゃるように、研究段階の治療法に関する専門的なアドバイスやナビゲートがあればどんなに良かったかと思います。
-
Sumito@RCJ
非常に貴重なご意見をありがとうございます。
今、私どもRCJの中でも理事長から同じような事をやりたいね、という話が出ています。
例えば、英国で実施された「OK to Ask」キャンペーンです。これは患者さんは治験・臨床試験について医師に「質問していいんですよ」というキャンペーンで
患者さんが、臨床試験についてどんどん質問することを奨励しました。その結果、英国全土で630,000人が治験に参加したいと申し出たそうです。
情報を公開して、治験を患者さんにちゃんと見えるようにすること、さらに主治医に質問する雰囲気や環境を作ることも大事ですね。ただでさえ少ない希少がんの治験ですので、必要な患者さんにはしっかりと届いて欲しいと思いますし、お二人のおっしゃる通り、見つけた後も参加までのサポートまでできるような仕組みを考えていきたいと思います。
-
-
-
まだまだ頑張り鯛
肉腫患者です。私は同じ病名の方がほとんどいません。
ネットで治療や薬の情報を探してみても「平滑筋肉腫」や「脂肪肉腫」の研究発表などは見かけるのですが、
自分の疾患名が全く出てこないので、いつも肉腫の中でも取り残された感じがしています。抗がん剤などの薬は「平滑筋肉腫」や「脂肪肉腫」などで聞いたとしても私の肉腫には効くのかわからないので
主治医からは「効くかわからないけどやってみよう」と言われ、保険適用になっている薬なのにも関わらず「お試し」状態で行っています。
効いたらラッキー!と思って開始しますが、効くか効かないかわからない抗がん剤を副作用と戦いながら続けるのはしんどいです。
また、効かなくて腫瘍が大きくなっていた時は本当に落ち込み、絶望したこともあります。今回のテーマの「ドラッグラグ」とは違うかと思いますが…
「希少がんは患者数が少ないから、研究データが少なくても治験開始申請が出来る」「治験に参加する患者さんは少なくても大丈夫」「希少がんは承認までが早い」
というようなお話を知り合った肉腫患者さんから聞いたことがあります。
(すみません、また聞きなのと少しうろ覚えなので、私の認識が違うかもしれません)もし本当なら、希少がんのデータを日本全国から一か所に集めて、治験の段階で患者が少ないがんでもどのくらい有効かわかって、
「お試し」状態でのスタートではなく、多少でも希望を持った状態でスタートが出来るのではないかと思いました。
先生が発した(と聞いています)こういう言葉を聞いてしまうと「いつ薬ができるんだろう」と期待してしまいます。
また、これからはがんの種類別ではなく遺伝子別に治療薬を使っていこうという考え方に変わっていると、ネットで読みました。
そうなれば、もっと使える薬が増えるのではないかとも期待しています。「効いたらラッキー」ではない治療が出来る日が、一日も早く来てほしいです。
わかりにくい文章ですみません。-
Sumito@RCJ
まだまだ頑張り鯛さん
今後、アジアの国々との共同治験が組まれるようになれば、患者数の少ない希少がんでも治験が増えていくでしょうね。患者さんの治療データや、手術時に採取した腫瘍サンプルの解析データの蓄積(レジストリ)が進むことによって、お薬が開発されるスピードや
精度も高くなっていきます。それで私たちも、MasterKeyプロジェクトへのレジストリー登録を薦めたり、プロジェクトの中のひとつひとつの治験
について、その情報を必要な患者さんへ届けるための試みを続けています。私の所属はGIST(消化管間質腫瘍)の患者会ですが、GISTもほんの20年前までは抗がん剤も放射線も効かない、難治性肉腫の代表でした。
ですが発病の原因となる遺伝子変異が特定され、お薬が開発されたおかげで、GIST患者さん達は長期生存が可能になっています。
いつ世紀の大発見が起きてもおかしくないのが今の時代です。ですからそれまでにできることをしていくことが大切です。
集まったデータで一日も早く治療薬が開発されてほしいですね。
-
-
ptsumi
患者家族です。ドラッグロスが深刻な現状も当然と言えば当然ですよ。この記事ですが、キートルーダといえば、今世界で一番売れている薬ですよね。年30%の成長率ってハンパないです。
それが日本に上市したら3年で半額に落とされて、販売数は増えてるのにマイナスって・・・
これではどの会社も、特にバイオベンチャーみたいに1つの薬に社運を賭けてるような会社は、絶対に日本で上市なんてしないですよ。
まずこの流れを止めないことには、ドラッグロスも止まりません。優秀な薬も入ってきません。
https://answers.ten-navi.com/pharmanews/21554/ -
草色の華
約3年前、娘がat/rtと診断され
頸椎神経からの原発巣を可能な限り切除後、
約半年 抗がん剤、陽子線治療後
再発が認められ、好中球上がるのを待って
治験に参加、
投薬後経過良く約8ヶ月癌が小さくなって行きましたが、原発巣が大きくなりまして、治験中止して
放射線治療、抗がん剤治療を行って頂きましたが効果段々と薄くなっています、
なんとか新しい治療(お薬)に出会えたらと願っています-
いなご
at/rt、ラブドイド患者家族です。
一般的な抗がん剤の選択肢はお聞きされているかと思いますので、分子標的薬の情報を参考までとなりますがお伝えします。ですが国内で使えない可能性が高く、その前提になりますがよろしければ参照いただければと思います。
不要でしたら以下は読まずに無視ください。他の方が少し書かれていたように、ips細胞を使った研究で、AT/RTに対してEZH2遺伝子を阻害すればよいと報告がありました。
https://www.ims.u-tokyo.ac.jp/imsut/content/900004342.pdfまた、
https://cancerinfo.tri-kobe.org/summary/detail_view?pdqID=CDR0000587224&lang=ja
の 再発小児CNS非定型奇形腫様/ラブドイド腫瘍の治療 に
にアメリカの治験情報があり、EZH2阻害剤のタゼメトスタット(tazemetostat)の治験情報があります。タゼメトスタットは成人では日本で別の病気で承認され、タズベリクとして販売されているものの、日本は小児の治験は行われていません。
ですので、薬は手に入るかもしれないがどうやって使うかが問題となります。また同じEZH2とEZH1を同時に阻害する分子標的薬(DS-3201b, valemetostat)の治験が日本であります。
https://ct.ganjoho.jp/category/ttrial/jRCT2031190268しかしながら、除外対象に以下の記述があり参加可能かはわかりません。
1) 活動性の重複がんを有する。ただし、以下の①〜③は除外しない。① 完全切除された、基底細胞癌、stage Iの有棘細胞癌、上皮内癌、粘膜内癌、表在性膀胱癌② 内視鏡的切除術で治癒切除された消化管癌③ 5年以上再発が認められない他のがん2) 用量漸増パートでは症状のある脳腫瘍、脳転移、がん性髄膜炎、放射線照射や外科的処置を要する脊椎転移を有する。
-
草色の華
いなご様早速の情報を有り難うございます、
頂いた情報を主治医様とすり合わせ等行って行きたいと思います。私なりにIPSの研究の進捗を調べているのですがat/RTに関しての進捗は未だ分からない状況です、
いなご様のご家族様もどうかお大事になさってください。
-
いなご
タズベリクでAT/RTへの患者申出療養のgoが出たようなので、見られているかわかりませんがお知らせします。
https://www.mhlw.go.jp/stf/shingi2/0000203222_00022.html-
Sumito
いなごさん
情報ありがとうございます。
企業さんの費用持ちですので、安心して受けられますね。
あとは承認申請まで持っていけるかですね。
-
-
-
-
Sumito@RCJ
草色の華さん
at/rt自体、比較的最近に疾患の概念が確立された病気なんですね。
治験も組まれているとの事でしたが、IPS細胞などの研究の記事も散見されました。
新たな治療法が早く確立されるよう、私たちも何かお手伝いできればと思います。-
草色の華
お返事ありがとうございます。
なんとか新しい情報ありましたらお教え願いたく思います。-
Sumito@RCJ
はい、承知です。
閲覧中の皆様からも、ぜひ情報提供をお願いいたします。
-
-
-
-
青赤ドングリ
2020年に自分自身が小腸GISTと診断され、摘出しました。その後、グリベックを2022年3月まで、内服していましたが、神経繊維腫のGISTでは、グリベックは効果は無いと言われました。その後、母も多発性の小腸GISTと診断されました。手術も内服治療も無いと言われました。神経繊維腫のGISTは、ホントに、内服治療も出来ないのでしょうか?
-
Sumito@RCJ
青赤どんぐりさん
NF-1関連GISTはグリベックが効きにくいことが報告されていますが、増殖が緩慢で予後が良いことでも知られています。
内服ができないという事ではなく、効果があまり期待できないことから、リスクとベネフィットを比べた結果のご意見
ではないかと推察します。お母様もNF-1関連GISTとの事、専門医のセカンドオピニオンで詳しくお聞きになるのも
良いかと思います。
ご参考までに
https://www.ndmc.ac.jp/wp-content/uploads/2021/04/46-1_006-011.pdf
-
-
橘樹郡
お返事をありがとうございます。
情報欲しいです。
よろしくお願いします。今回のサミットはドラッグ・ラグがテーマですね。
よく耳にするのですが、内容については何となくという程度であまり分かっていません。
5月頃のニュースで岸田総理が、ドラッグ・ラグは解消されているような話をされていましたが、実際には拡大ですか?
患者会仲間にも詳しい人がいて、海外からお薬が入ってこないといつも話しています。実際どうなのでしょうか?-
Sumito@RCJ
-
-
Yoshino
どうすりゃいい野さん
私の家族が小腸の腺がんでした。
抗がん剤治療も試しましたがあまり効果がなく
次の治療を探さなければなりませんでした。
残念ながら間に合いませんでしたが、
遺伝子変異を調べるパネル検査を受ける予定で
少ない確率だけど、小腸腺がんである種の変異
が見つかることがあると。その変異があれば
承認されているお薬があるとの事でした。
海外の学会で発表されているとか・・
詳しい話は忘れてしまいましたが、希望はあると
知ってほしくて書き込みました。 -
kim
こんにちは
こうした話を皆さんと一緒にする機会をありがとうございます。
海外ベンチャー発の薬が日本に入ってこないことで困っています。海外で承認された国内未承認薬であっても必要な人の手に届くように、という思いでつくられたのが患者申出療養制度のはず。ですがこれだけ薬価が高くなるとその薬を自費で購入することがままなりません。せっかく作られた制度なので検討した上で、場合によっては少数であってもしっかりここでデータを集積し効果が検証された場合は最短で承認への道をつくる、というような、通常の治験のプロセスに代わる仕組みを作れないものかなと思います。
すでに世界では商品化されたというのにこのあと日本で大金をかけて治験を組み承認までの長いステップを踏む、あるいはそこから先を引き受けてくれる企業を探す、しかも患者数はそう多くはない(これ、希少がんだからじゃなくて患者数が多いがんの中の希少フラクションでもそうですよね)、そうなるとそりゃ二の足を踏む企業の事情もあるでしょう。
企業が二の足を踏むようなコストはかからずに済むよう申出療養の中で日本人のデータを蓄積し承認を目指すイメージです。今後の対策として日本は全力で開発の初期の段階から世界と共同で取り組んでいけばよいのかもしれない。日本発の薬や機器を!と力を入れるの本当にもすばらしいこと。
でも今、現に日本だけ取り残されてしまった製品に対しては上記のようにしくみを何とかして「今の日本だからこの薬が手に入らない」状況をカバーしたいです。 -
どうすりゃいい野
小腸腺がんの患者家族です。
基本的に標準治療がないと突き放される
グレイゾーンの対応として
FOLFOXが唯一の対応と言われ。
病の発覚当初から崖っぷちを宣言され
治療のステップ数、期間が限られた中
文献をあたり、あらゆる可能性を模索。
自分なり、一般的にみて怪しいものは
ふるいにかけて、少しでも可能性を感じるものを選んで
主治医やその研究機関へ相談するも
殆どが、そもそも研究対象のがん種に
選ばれていないため
治験参加は叶わない。
ひどいのは、主治医の病院が
組織的な問題でそれを拒む。希少がんとされるがん種は
症例が少ない、
研究対象にならない、
予算がつかない、
病院も製薬会社も積極的にならない、
治療法が確立しない、
患者は希望が持てない、の、無い無いループにはまり
抜け出す道がない。そんな現状を知るのは
極限られた、希少がんの
患者とその家族くらいの
極少数の人々。
どうにかしたい。
どうにかして欲しい。
せめて、一緒に考えてくれる
知見ある方のご協力が欲しい。そんな気持ちです。
ないないループの中
必死で自分たちで勉強して
対処法、治療法をさがして
こざるを得ない状況
自費治療で遠方通院等
それならば、
治療法が無い期間だけでも
せめて、
条件付きの難病指定にするなど
実情にあわせたフォロー対応があってほしい。自費治療への判断ばかりを迫られ
医療制度の、誰も一生懸命になってくれない
エアポケットに吸い込まれた状況。
どうすりゃいいの。。。※勿論、熱心になってくださる
医師もなかにはいらして
現在治療に当たってくださっている
医師の方々には本当に感謝しています。 -
橘樹郡
血液がんの患者家族です。希少がんサミットのご開催ありがとうございます。
最近、新しい薬剤が次々と登場しておりますが、対象患者がカッチリ決められていて、海外のように試験的に様々な治療ステージで使用されたり
ということはないですし、少ない症例数でも効いたという話を聞くと、可能性に賭ける事もできないのは辛いです。
また地域によって新薬の普及率が違っているようでもあります。希少がんの患者は特に、自分で一生懸命調べても海外で普通に使われている薬にさえ
たどり着けないことが多いと思います。もっと情報量を増やして行けば、日本に薬がないことが分かりもっと大きなムーブメントになるのではないで
しょうか。皆さんを応援しています。-
Sumito@RCJ
橘樹郡さん
お薬は、対象となる患者さんに対して治験でお薬を投与してみて、効果が確認されて初めて承認される、この繰り返しで適応を広げていきます。
効果が確認されて承認されるまでは適応外薬ですので、保険診療医の先生方には、その使用は制限されてしまいます。
ですがおっしゃる通り、ご自身の疾患に対して海外で承認されているお薬の情報って、本当に頑張って調べないとたどり着けないですよね。
まずは情報が患者さんやご家族に届く事、そして同じ疾患、同じお薬を待っている患者さんやご家族がつながれる仕組みがあれば、情報交換が
可能になり、ドラッグラグなどの問題点もはっきりとしてきますね。
私達RCJのraccoon(ラクーン)もそういう場を作りたくて立ち上げています。よろしければご活用ください。
https://raccoon.rarecancersjapan.org/-
jazz826
初めまして。よろしくお願いします。所で、ラクーンですが、ページ見つかりませんでした。
-
あず@RCJ
-
Sumito@RCJ
失礼しました・・・!!!
-
-
-
-
-
Sumito@RCJ
(テスト投稿)
皆さま、こんにちは。このたび9月17日(土)13:00より、第3回 希少がん患者サミットを開催させていただく事となりました。
今回は、過去のアンケートでも解消を望む声の多かった「ドラッグ・ラグ」をテーマとさせていただきました。様々なデータから、ここ数年の間にドラッグラグが再燃しているのは間違いありません。
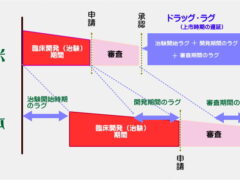
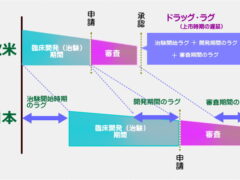
ただ、私たちが十数年前に直面していたドラッグラグとは、少し様子が違ってきているようです。そもそもドラッグラグとは、未承認薬、適応外薬の問題を総称する形で使われてきました。
また、このラグの構成要素も、開発ラグ、審査ラグ、申請ラグの3つで、ほとんどは開発ラグと審査ラグでした。
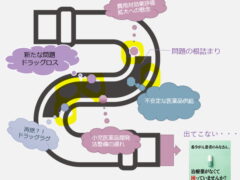
この未承認薬、適応外薬、そしてラグの構成要素の開発ラグ、審査ラグにつきましては添付の図もご覧ください。〇未承認薬問題:すでに海外では承認されている治療薬が、日本では承認されない、または承認されるまでに長い
年月を要する、という問題。〇適応外薬問題:海外では疾患Aと疾患Bで承認されている治療薬が、日本では疾患Aしか承認されておらず、疾患B
では使えない、という問題。●開発ラグ:臨床試験(治験)の開始に遅れた期間、また被験者のリクルート等に時間を要して生じた遅延期間の合計
●審査ラグ:審査に時間を要し、結果的に海外に比べてかかってしまった期間サミット開催に先立ちまして、まずはドラッグラグに関する経緯、どのような取り組みがされてきたのかを
次回より何回かに分けてご説明していきたいと思います。 並行して皆様の声も集めておりますので、ご意見・ご質問等も
ぜひ書き込んでください。添付ファイル:
-
Sumito@RCJ
(事務局投稿その2です)
前回はドラッグラグの内容について簡単に書かせていただきましたが、そもそも、なぜ、このドラッグラグが問題なのかを少しお話しします。私が個人的に調べたものですので、もし事実と違う部分がありましたら、遠慮なくご指摘ください。日本では製薬企業さんが あるお薬の製造販売承認を取得すると、そのお薬は同時に保険診療で使うことができるようになり、しかも高額療養費制度や限度額認定により、一定額以上の医療費は減免してもらう事ができます。
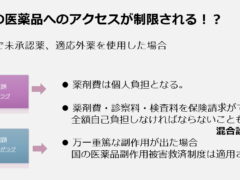
国民皆保険制度は安価な医療費で高度な医療が受けられる、実に素晴らしい保険制度です。ですが国内で承認されていなければ、どんなに海外で十分なエビデンスがあるお薬でも、合理的に考えてそのお薬の服用がベストであるとしても、服用するための費用は自己負担になってしまいます。しかも混合診療の禁止規定により、お薬以外のすべての医療費までが全額自己負担となってしまうこともあるのです。
これは私個人の意見ですが、未承認薬や適応外薬使用についての一番の問題は、命に係わるやむを得ない状況での選択なのに、救済措置も経済的な支援も受けられず、またそれによって患者さんやご家族がさらに苦しい思いをする。という事だと思います。(ただこの規制がなければ、国内は怪しげな薬で溢れかえってしまいますが・・)
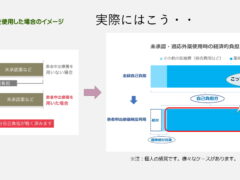
適応外薬も同じです。しかも国内で他の疾患では使えるお薬で、その疾患の患者さんが処方されていくのをただ見ているしかないのですから、手の届くところにあるのに届かないというのは本当に苦しいと思います。※混合診療とは公的医療保険制度が適用される保険診療と適用されない自由診療とを併用した診療のことを言います。保険診療では患者が診療費の一部を負担しますが、自由診療では保険が適応されないため全額が患者負担となります。日本では混合診療を原則、禁止しており、混合診療を行った場合は、通常保険診療となる部分も含めたすべての医療費が自由診療扱いとなり全額を患者が負担しなければならないことがあります。
2016年の4月にスタートした「患者申出療養制度」については、未承認薬や適応外薬を「保険外併用療養」として使用したいという患者さんの要望に応え、つまり混合診療の問題の解消のために導入されましたが、経済的な負担がほとんど変わらず、申請のために山ほど書類を書かなくてはならないという点で、患者の支援制度としては非常に弱いと言わざるを得ません。厚労省のパンフでは経済的負担が半分近く減るような図が示されていますが(下図)実際にはほとんどが薬剤費であることから、制度を利用できる患者さんは限定されるでしょう。
ただ、最近はMASTER KEYプロジェクト の中で実施されている一部の試験のように、製薬企業さんが協賛に入り、薬剤費がカバーされる医師主導治験の受け皿として活用され始めています。
もう少し申出申請が簡素化されれば、活用事例も増えるでしょう。〇厚生労働省 患者申出療養制度
https://www.mhlw.go.jp/moushideryouyou/〇国立がん研究センター中央病院 治療選択肢の可能性を求めて(患者申出療養制度)
https://www.ncc.go.jp/jp/ncch/genome/90/index.html〇国立がん研究センター中央病院 NCCH1901(受け皿試験)医薬品リスト
https://www.ncc.go.jp/jp/ncch/genome/90/NCCH1901_PRT_iyakuhinlist_ver6.0.docx.pdf今回は私が考えるドラッグラグの(一番の)問題点をお話ししました。次回はこのドラッグラグに対してどのような方策がとられてきたのか、その方策がどのような成果を上げてきたのかを書いてみたいと思います。
添付ファイル:
-
Sumito@RCJ
さて、これまでドラッグラグに関しては様々な方策がとられ、中にはきっちりと成果を上げているものもあります。
今回からそのいくつかをご紹介していきます。ドラッグラグは、そう呼ばれる前から「未承認薬問題」として認識はされており、問題意識の共有が患者会となり、患者会の連合を生み、2005年「第一回がん患者大集会」開催など、かなりの大きなうねりとなりました。2007年「がん対策基本法」も、この流れが後押ししたと言ってよいと思います。ただその割には基本法の施行後も扱いが小さく、なかなか本格的な解消へと動くことがありませんでした。
その後もドラッグラグを抱えた患者会は各々で要望書を提出するなど、未承認薬、適応外薬の問題解消に向けて動き始めていましたが、2011年J-CANがまとめた「がん患者会60団体の有志一同」による要望書提出などもあり、厚労省、PMDA、中医協などが動き出します。
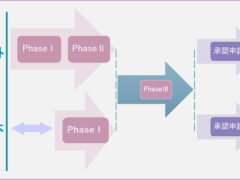
ドラッグラグは開発ラグと審査ラグで構成されますが、開発ラグへの方策として、国際共同治験への参加を強化したことが挙げられます。
国際共同治験参加の流れですが、まず治験スタートアップ国(海外)で治験がスタートしますが、phaseⅠの結果を確認し、治験の継続が可能という判断が出た後に、ようやく日本でもphaseⅠ試験をスタートさせます。この国内のphaseⅠ試験のデータと海外のデータを利用して、日本でのphaseⅡを省略し、他国とも合同でphaseⅢ試験を実施します。治験への着手は遅れますが、治験終了時には世界と揃います。国際共同治験に参加するメリットは
・世界同時開発・申請・承認が可能に。(実際には日本は翻訳作業などが原因で必ず少し遅れます・・)
・必要な人数を短期間で集められる。
・人種、人数が多くなるため、発現頻度が低い副作用も見つけられる可能性が高まる。
・有効性・安全性に民族差があるかどうかを見つけやすい。等が挙げられます。
次回は審査ラグについて書きます。
添付ファイル:
-
Sumito@RCJ
ちょっと思い出したことがあります。
少しの前(10年程まえ)の話ですが、日本はドラッグラグで世界に4年間遅れている、内訳は開発ラグで1年、審査ラグで1年、後の2年は製薬会社が日本で治験を実施してこの薬を発売するか考える時間、と言われていました。最初は軽いジョークかと思っていたのですが、この「2年間考える」というのはまんざらジョークでもないようです。GISTの患者さんであればよくわかると思うのですが、昨年10月の用途特許切れ以降、グリベックを後発薬(ジェネリック)に切り替えた方はどのくらいいらっしゃるでしょうか?海外であれば保険会社がほぼ強制的に後発薬に変更させますので、特許が切れたとたん先発薬の売り上げは一気に降下します。ですが日本では薬剤を選ぶ権利が保障されており、今でも多くの患者さんがグリベックを服用しています。つまり売り上げは緩やかに下がりこそすれ、一気に落ちることはない。ですから海外のようにできるだけ早く発売して、特許が切れる前に一気に利益を回収する必要がないのです。
リスクを冒して多数の国で同時にphaseⅠ試験を始めるのではなく、まず環境の整った国で開発をはじめ、順調に利益が出るようになってから日本などで発売するかどうか(2年くらい・・)考えればよい、という訳です。。この事が以前はドラッグラグを助長する原因の一つと考えていましたが、今は海外から企業を呼び込むための日本のアピールポイントとしても使えるかな‥などとも考えています。
ちょっと思い出したので書いておきます。
-
-
投稿者投稿

この掲示板は、希少がんのお薬に関してのご経験やご意見をみなさんから聞き、みんなで考えていくページです。
ぜひページ下の投稿欄より貴重なご意見をお聞かせください。
なお、投稿には、患者、家族などお立場も入れてご投稿ください。医療者や企業の方の投稿も大歓迎です。
※設置していたお立場欄を削除し、投稿内にいれていただくことにしました。(2022年9月4日:仕様変更)
この掲示板は公開されていますので、一般的なWEB掲示板やSNSと同様のご注意が必要です。
「投稿にあたってのご注意」のページをご一読ください。